Cancer Cell:RNA结合蛋白控制细胞周期检查点驱动肿瘤治疗
 2016-05-25来源:未知
2016-05-25来源:未知2015年10月22日,国际学术期刊《Cell》子刊《Cancer Cell》在线发表麻省理工大学Michael B. Yaffe的一篇研究论文,研究论文指出一项RNA结合蛋白控制细胞周期检查点驱动肿瘤治疗的机制。
麻省理工学院(MIT)的癌症生物学家已经发现了缺失p53基因引发的肿瘤是如何发生的:当p53缺失时,一个备份系统会接管,刺激癌细胞继续分裂,即使当它们遭受了广泛的DNA损伤。研究人员还发现,一个被称为hnRNPA0的RNA结合蛋白,是该通路的一个关键参与因子。Koch综合癌症研究所成员Michael Yaffe教授指出:“我认为,当p53缺席的时候,这个特定的RNA结合蛋白,使肿瘤细胞对杀死它们的化疗产生了耐药性。”
这些研究结果表明,阻断该备份系统,可以使p53缺陷的肿瘤对化疗更敏感。这也有可能使我们通过测量这个系统在患者肿瘤中有多活跃,来预测哪些患者最有可能从化疗中获益。
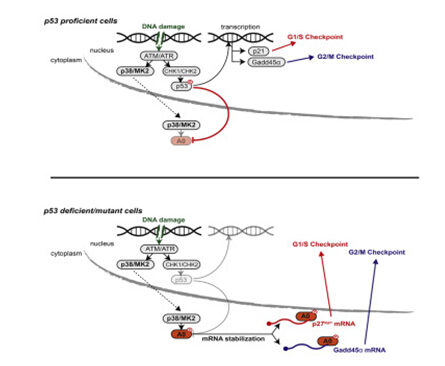
在健康的细胞中,p53可监督细胞分裂的过程,必要时停止分裂以修复DNA损伤。如果伤害太大,p53就会诱导细胞发生程序性细胞死亡。
在许多癌细胞中,如果p53基因丢失,细胞就经历了一个重装自我的过程,在该过程中,一个备份系统——称为MK2通路,可取代p53的部分功能。MK2通路,可使细胞对DNA损伤进行修复,并继续分裂,但如果伤害太大,它不会强迫细胞经受细胞自杀。这使得癌细胞在化疗后继续不受控制的增长。
Yaffe在2013年首先发现了这一备份系统,他指出:“只修复p53功能的坏的部分,但不修复p53功能你想要的那部分,这部分功能正在杀死肿瘤细胞。”
在新的研究中,研究人员深入探究了这一途径,发现MK2蛋白通过激活hnRNPA0 RNA结合蛋白而发挥控制作用。
RNA结合蛋白是与RNA结合的蛋白质,有助于控制基因表达的许多方面。例如,一些RNA结合蛋白可结合信使RNA(mRNA),它携带从DNA复制的遗传信息。这种结合能使mRNA稳定下来,并有助于它停留较长的时间,这样它所编码的蛋白质将会更大量地产生。
本文第一作者Ian Cannell表示:“作为一个类别,RNA结合蛋白正越来越被重视,因为它们对于癌症治疗反应是非常重要的。但这些蛋白在分子水平上是如何起作用的,完全是未知的。”
Cannell发现,hnRNPA0在细胞分裂过程中负责两个不同的检查点。在健康的细胞中,这些检查点可以让细胞停下来修复染色体复制过程中可能出现的基因异常。
其中的一个检查站,被称为G2/ M,是由一种名为Gadd45的蛋白控制的,它通常是通过p53激活的。在没有p53的肺癌细胞中,hnRNPA0可稳定编码Gadd45的mRNA。在另一个称为G1/S的检查点上,p53正常打开蛋白质p21。当p53缺失时,hnRNPA0可稳定编码p27(p21的一个备份)蛋白的mRNA。总之,Gadd45和p27可帮助癌细胞中止细胞周期,并修复DNA,因此它们可以继续分裂。
研究人员还发现,测量Gadd45和p27的mRNA水平,可以帮助预测患者对化疗的反应。在一个2期肺癌患者的临床试验中,他们发现,治疗反应最好的患者中,这两个蛋白的mRNA水平都很低。那些水平高的人则没有从化疗中获益。
Yaffe说:“你可以在病人样本中测量这个通路控制的RNA,并将其用作这一通路存在或不存在的指示器。在这项试验中,它非常善于预测哪些患者会对化疗产生反应,哪些患者没有反应。”
MK2通路也可以作为新药的一个很好靶标,使肿瘤对DNA损伤的化疗药物更敏感。Yaffe的实验室现在正在小鼠中测试可能的药物,包括基于纳米颗粒的海绵,它们会吸收所有的RNA结合蛋白,这样它就不再能促进细胞存活。
原文链接:A Pleiotropic RNA-Binding Protein Controls Distinct Cell Cycle Checkpoints to Drive Resistance of p53-Defective Tumors to Chemotherapy
原文摘要:In normal cells, p53 is activated by DNA damage checkpoint kinases to simultaneously control the G1/S and G2/M cell cycle checkpoints through transcriptional induction of p21cip1 and Gadd45α. In p53-mutant tumors, cell cycle checkpoints are rewired, leading to dependency on the p38/MK2 pathway to survive DNA-damaging chemotherapy. Here we show that the RNA binding protein hnRNPA0 is the “successor” to p53 for checkpoint control. Like p53, hnRNPA0 is activated by a checkpoint kinase (MK2) and simultaneously controls both cell cycle checkpoints through distinct target mRNAs, but unlike p53, this is through the post-transcriptional stabilization of p27Kip1 and Gadd45α mRNAs. This pathway drives cisplatin resistance in lung cancer, demonstrating the importance of post-transcriptional RNA control to chemotherapy response.



