细胞活性的检测方法比较
 2016-05-25来源:未知
2016-05-25来源:未知
细胞活性的定义具有多样性,通过对关键的细胞生理指标进行标记来进行检测,如细胞代谢的活性(酯酶的功能,MTT法)、凋亡标记物(Annexin V)、细胞氧化还原电位、膜电位、增值率(DNA含量)、线粒体功能和膜的完整性等。虽然有如此多的指标参数,但是基于对细胞膜的完整性和相关的染料排斥发检测,已经被广泛的认为是作为细胞活性检测的标准。应用最广泛的细胞膜完整性的检测方法是台盼蓝染色法,该法最早是基于显微镜下观测并且手工计数,过程费事费力,并且计数的系统误差较大。为了排除人工计数的误差,增加计数过程的准确性,出现了基于仪器放大、拍照计数的方法。这样提高了计数过程的自动化程度,但是依旧无法摆脱由于计数时焦平面的选择、颗粒识别的准确性问题,并且容易高估细胞活性。为了解决这些问题,一些荧光染料被发明进行使用。该法能够较台盼蓝染色提高100倍或者更高的检测准确性与灵敏度。这类型的荧光染料中,碘化丙啶(Propidium Iodidi,PI)是应用最广泛的一种标准染料。
与其他基于荧光染料标记的实验一样,该法的缺点就是需要使用荧光显微镜或者是流式细胞仪。前者要求配置一套荧光显微镜,相对应的激发光源以及滤光片,并且操作过程依旧是手工操作,人工计算实验结果,过程耗时还无法避免人为的主观因素。而流式细胞仪能够准确的计数,并且进行统计学分析,但是设备昂贵,需要有经验的实验人员进行专门操作,以及需要一定的设备维护等问题。
Orflo公司创新性的研发出了第一台便携的流式检测系统,能够提供高精度的PI活性检测的实验数据,仪器无需预热,无需清洁与维护,检测快速,不需要专门的仪器操作人员和相关背景知识的人员。Moxi Flow是世界上第一台结合库尔特原理(精确颗粒计数和粒径分析)和单荧光通道(PMT)检测的便携流式。本文中将对几种不同的细胞活性检测方法进行比较。
图1-Orflo Moxi Flow系统及芯片,Moxi Flow是世界上第一台便携流式细胞计数仪,它结合了基于阻抗法和荧光通道的检测,预设了常用的检测程序,无需设置复杂参数,无需进行复杂操作,芯片即插即用方便快捷。
实验方法
细胞杀伤处理
分别用加热(60℃,30min)、500mM过氧化氢(H2O2,Sigma)、饥饿处理(1周)的方法处理细胞,每组实验根据比例分别用空白对照的细胞配置成不同标准活细胞比例浓度组。
活性检测
将经过杀伤处理的细胞与未处理的空白对照细胞进行一定比例的混合,配置成活细胞比例分别为100%、85%、70%、55%、40%、25%、10%和0的标准品,分别用Moxi Flow(Orflo Technologies)、Guava PCA流式细胞仪(Merck Millipore)、基于台盼蓝染色的成像计数仪(TC-10,BioRad)和血球计数板(n=3)。后续数据使用软件IGOR Pro(Wavemetrics)进行分析作图。
Moxi Flow计数和活性检测
细胞样本用5μg/ml的PI染色(Life Technologies),孵育5min,所有染色后的样本在20min内完成检测,所有分析操作均在Moxi Flow仪器上进行。
Guava PCA计数和活性分析
待测的细胞样品50μL与450μL的Viacount试剂(Merck Millipore)混合,孵育5min,所有染色后的样本在20min内完成检测,数据使用FlowJo软件包(Treestar)进行处理分析。
成像系统与血球计数板计数和活性检测
0.4%的台盼蓝溶液(Life Technologies)按照1:1的体积比例与细胞悬液混合,吹打10次充分混匀。混匀后的样本即可使用成像系统拍照计数或者使用血球计数板计算。
结果与讨论
Moxi Flow系统提供双通道的检测信息:1)基于电阻抗法的细胞粒径分析(库尔特原理);2)荧光通道的信号强度(532nm激发,590/40nm检测)。图2为Moxi Flow的检测结果,使用Moxi Flow对多种不同细胞,不同杀伤处理的方法的细胞进行的PI染色的活性检测。实验结果图以散点图的形式展示,横坐标为基于库尔特原理检测的细胞粒径(μm),纵坐标为基于荧光信号强度值。由于该方法的检测与细胞的形态学改变无关,所以可以明确的根据细胞染色的情况分辨出活细胞与死细胞的类群。
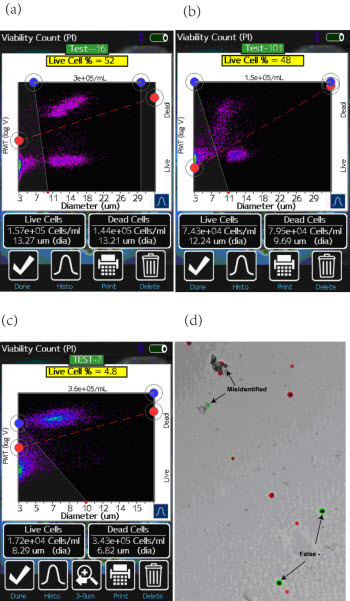
图2—Moxi Flow与TC10检测结果。(a)为Jurkat E6-1细胞经60℃热处理后,使用Moxi Flow检测的细胞活性,散点图;(b)为CHO-1细胞经H2O2处理后,使用Moxi Flow检测的细胞活性,散点图;(c)为3T3细胞经饥饿处理后,使用Moxi Flow检测的细胞活性,散点图;(d)为饥饿处理的3T3细胞,台盼蓝染色后使用TC10检测。
对比基于台盼蓝染色成像计数的方法,与前者有显著的不同。Moxi Flow根据纵坐标的信号强度来区分死活细胞的类群,而图像法需要根据被测样本的颜色深浅来判断是否为死细胞(染色后颜色变深),另外对于一些细胞的皱缩、形态的改变、对于细胞碎片的判断存在很大的系统误差,所以对于整体细胞活性的判别具有一定的系统误差。
将预先配置好已知理论存活率的细胞样本进行检测,统计不同系统的试剂检测存活率与理论存活率相比,比较不同系统的差异,结果如图3所示。
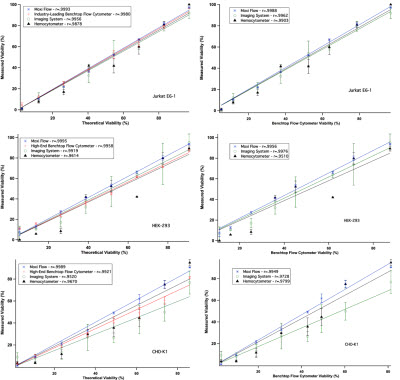
图3—左侧栏为Moxi Flow、Guava PCA、TC10和血球计数板分别检测三种细胞(Jurkat E6-1、CHO-K1、HEK-293)的细胞存活率与理论细胞存活率的比较;右侧栏为Moxi Flow、TC10、血球计数板的检测结果与台式流式细胞仪的检测结果比较分析;Moxi Flow检测结果的线性关系、标准差都显著优于基于台盼蓝染色检测的结果。
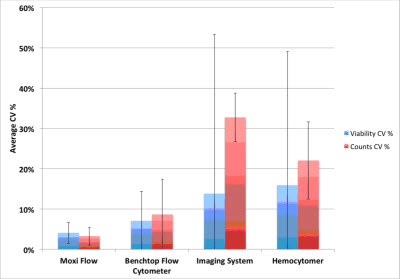
基于图像计数的方法,无论是仪器设备自动计数还是使用手工的血球计数板计数,检测的存活率与理论存活率都存在着很大的差异,并且组内的差异CV值很高(如图4)。而便携流式Moxi Flow与高端的台式流式Guava PCA,二者具有相似的实验结果,检测的细胞存活率与理论存活率都接近,并且CV值更低(如图4)。
总结
从以上的结果可以看出,Moxi Flow作为第一台便携的流式细胞计数仪,具有优越的检测准确性和重复性,仪器的操作更简单,具有更高端台式流式相媲美的实验数据。除了优越的仪器性能,Moxi Flow与传统的高端台式流式相比,还具有更强的便携性、更高的性价比、无需开机预热、无需系统清洁与维护、检测快速(15s)、无需专人操作等特点,这让我们相信,Moxi Flow会成为未来检测细胞活性的新方法与新标准。
此文转载来源:百度学术



