Cell Stem Cell:科学家联合揭示人诱导多能干细胞免疫原性呈差异性呈递
 2016-05-25来源:未知
2016-05-25来源:未知9月3日发表于国际学术期刊Cell Stem Cell 发表南方医科大学肿瘤研究中心徐洋教授为通讯作者的一篇研究文章。研究发现一种重要的干细胞-由自身细胞重编程而得的人类“诱导多能干细胞”( iPSCs)分化生成的各种类型的功能细胞,可以显示不同的免疫原性。在研究中,研究人员从人iPSCs分化出多种细胞类型,并建立了具有同一个体免疫系统的人源化小鼠来测试其免疫排斥反应。他们发现自体iPSC分化的平滑肌细胞具有高度“免疫原性”,受到人源化小鼠免疫系统的排斥。但iPSC分化的视网膜色素上皮细胞却不会遭受免疫系统排斥,这一研究结果为开发iPSC分化的视网膜色素上皮细胞来治疗黄斑变性带来了希望,而黄斑变性是导致老年人失明和视力损害的一个主要退化性疾病。
尽管小鼠诱导多能干细胞分化产物免疫原性的研究已经取得重要进展,然而由于缺乏合适的体内模型,人诱导多能干细胞分化产生的免疫原性仍未阐明(Zhao et al, 2011; Araki et al, 2012; Almeida et al, 2014)。通过给免疫缺陷小鼠(如NSG)共移植人胚胎胸腺组织和CD34+细胞可以建立功能性免疫系统人源化小鼠。此人源化小鼠有多系人淋巴造血细胞的重建并具有功能性人免疫系统,可产生抗原特异性T细胞和抗体反应,包括产生T细胞依赖性抗体及介导移植排斥和抗病毒免疫反应(Tonomura et al, 2008; Rong et al, 2014)。
由南方医科大学、中国科学院动物研究所、加州大学圣地亚哥分校、斯克利普斯研究所及吉林大学等6家单位组成的国际联合攻关小组研究发现人诱导多能干细胞免疫原性呈差异性呈递。研究人员首先证实功能人源化小鼠可以有效地排斥同种异体人胚胎干细胞分化的细胞。随后,研究人员在批量建立该人源化小鼠的同时,将同一个人的成纤维细胞重编程为非整合的诱导多能干细胞,研究了其分化细胞的免疫原性。通过畸胎瘤模型首先鉴定出诱导多能干细胞分化的肌肉组织倾向于引起排斥反应,而视网膜色素上皮细胞不会引起排斥反应。随后体外分化人诱导多能干细胞获得肌肉及视网膜色素上皮细胞,并发现了同畸胎瘤模型中相一致的免疫原性。分子机制研究表明不同组织中抗原的差异性表达是引起这一免疫原性区别的根本原因。
该研究建立了人诱导多能干细胞分化组织免疫原性研究的范例,为其它人诱导多能干细胞分化组织的免疫原性研究及其临床开发奠定了基础。同时该研究亦从免疫学的角度支持人诱导多能干细胞分化的视网膜色素上皮细胞的临床实验。
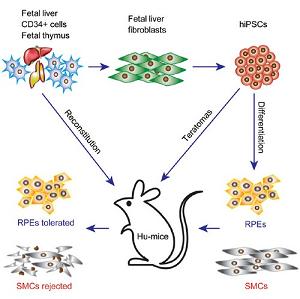
图:人诱导多能干细胞免疫原性呈差异性呈递
原文链接:Humanized Mice Reveal Differential Immunogenicity of Cells Derived from Autologous Induced Pluripotent Stem Cells
原文摘要:The breakthrough of induced pluripotent stem cell (iPSC) technology has raised the possibility that patient-specific iPSCs may become a renewable source of autologous cells for cell therapy without the concern of immune rejection. However, the immunogenicity of autologous human iPSC (hiPSC)-derived cells is not well understood. Using a humanized mouse model (denoted Hu-mice) reconstituted with a functional human immune system, we demonstrate that most teratomas formed by autologous integration-free hiPSCs exhibit local infiltration of antigen-specific T cells and associated tissue necrosis, indicating immune rejection of certain hiPSC-derived cells. In this context, autologous hiPSC-derived smooth muscle cells (SMCs) appear to be highly immunogenic, while autologous hiPSC-derived retinal pigment epithelial (RPE) cells are immune tolerated even in non-ocular locations. This differential immunogenicity is due in part to abnormal expression of immunogenic antigens in hiPSC-derived SMCs, but not in hiPSC-derived RPEs. These findings support the feasibility of developing hiPSC-derived RPEs for treating macular degeneration.



